Malassezia pachydermatis – дрожжевой грибок, относящийся к нормальной микрофлоре кожи и ушной раковины. Его роль как самостоятельного первичного возбудителя кожного заболевания остается весьма противоречивой. Malassezia также часто присутствует как сапрофит в носу, в межпальцевой области, а также на губах, в прямой кишке и во влагалище кошек и собак. Было установлено наличие симбиотических отношений между Malassezia и стафилококками, поэтому, при посевах с пораженной кожи, они не редко выделяются совместно.
Поскольку Malassezia всегда присутствует на здоровой коже, то клиническое проявление дерматита, связанного с этими микроорганизмами, обусловлено изменением физико-химического состава кожи и многочисленными предрасполагающими факторами.
Чрезмерное образование сального секрета, повышение влажности и нарушение эпидермального барьера способствуют росту дрожжевой микрофлоры. Предрасполагающими моментами могут быть частые купания, аллергические заболевания, себорея, повреждения кожи, длительное применение кортикостероидов и антибиотиков, внутренние болезни (особенно нарушающие жировой обмен), эндокринные заболевания и другое.
Возможно, есть генетическая основа для предрасположенности некоторых пород к малассезному дерматиту (вест-хайленд-уайт терьер, бассетхаунд, спаниель, немецкая овчарка, чихуахуа, пудель, лхаский апсо, такса).
Malassezia, также, часто принимает участие в развитии воспаления при дерматите кожных складок.
Некоторые исследования показали, что у собак с атопией наблюдалась IgE-опосредованная гиперчувствительная реакция типа 1 на Malassezia.
Аллергия на дрожжи рода Malassezia у больных атопическим дерматитом
Липофильные дрожжи рода Malassezia, обитающие на коже человека, обладают уникальными свойствами, особо выделяющими их из царства грибов. Уникальность состоит в том, что они представляют собой яркий пример способности микроорганизма в зависимости от условий окружающей среды и иммунитета хозяина проявлять свойства комменсала или патогена. Кроме того, это единственный представитель микрофлоры человека, для жизнедеятельности которого необходимы жиры. Ни один из других видов грибов не обладает качеством облигатной липофильности.
История вопроса. Практически у каждого человека кожа, особенно верхней части тела, колонизирована грибами рода Malassezia. Казалось бы, именно поэтому исследование физиологии этого постоянного спутника человеческого организма должно быть всесторонним. Между тем эволюция изучения особенностей сожительства хозяина и грибка в течение более чем столетия сопровождалась множеством ошибок и неточностей. Впервые их описал в 1846 году микробиолог Eichstedt [1]. После этого долгое время исследование физиологических свойств этих грибов было затруднено в связи с тем, что не удавалось их культивировать. Не приживались эти дрожжи на средах, которые обычно использовались для культур других грибов. И только когда в 1939 году доктор Benham догадалась, что для жизнедеятельности этих грибов необходимы жиры, появилась возможность получить культуру Malassezia spp. [2]. Сложность идентификации видов состояла еще и в том, что для грибов рода Malassezia типичен диморфизм, то есть способность пребывания как в дрожжевой, так и в мицелиальной фазе. Поэтому многие исследователи предполагали, что эти фазы не что иное, как различные представители дрожжевой флоры: род Pityrosporum — дрожжевая форма, а Malassezia — мицелиальная. Кроме того, вариабельность формы дрожжей принималась микробиологами за разные виды: круглая форма клетки — Pityrosporum orbiculare, а овальная — Pityrosporum ovale. Таким образом, таксономия и номенклатура рода Malassezia до последнего времени была запутана и хаотична [3, 4]. В связи с тем, что так и не было доказано наличие двух фаз жизнедеятельности дрожжей, в классификации присутствовали оба рода. Эта ситуация прояснилась только в 1977 году, когда три независимые группы микологов опубликовали данные о том, что им удалось создать условия, при которых дрожжевые клетки продуцировали гифы in vitro. Используя различные вариации культуральных условий, им удалось получить гифы, отличные от штаммов, изолированных от пациентов с разноцветным лишаем. Было показано, что гифы способны образовывать как круглые, так и овальные формы дрожжевых клеток, поэтому было сделано предположение, что форма клетки — это фаза жизненного цикла микроорганизма.
Таким образом, прогресс в познании грибов рода Malassezia лишь к 1996 году позволил авторам Guillot и Gueho установить порядок в таксономии [5]. Они зарегистрировали 104 штамма Malassezia spр., идентифицированных характеристикой ДНК, определяемой методами полимеразной цепной реакции. На основании этих данных они определили и назвали 7 видов рода Malassezia: M. furfur, M. sympodialis, M. obtusa, M. globosa, M. restricta, M. slooffiae и M. pachydermatis [6].
Биология, физиология, экология Malassezia spp. В связи с проблемами культивирования биология, физиология, экология Malassezia spр. исследована плохо. Основной отличительной особенностью этих дрожжей является их неспособность к ферментации сахаров. Главный источник углерода для них — жиры. Несмотря на то, что микроорганизм можно вырастить в аэробных условиях, он выживает и в анаэробных условиях. Предполагается, что жирные кислоты не являются источником энергии и не участвуют в метаболизме, но представляют собой неотъемлемую составную часть клетки. Обнаруженные липиды внутри клеток эпидермиса имеют состав, необходимый для питания дрожжевых клеток [7]. Сложность получения культуральных экстрактов до последнего времени не позволяла проводить исследования IgE опосредованной реактивности in vivo и in vitro. И только в последние 20 лет появилась возможность определения роли грибов Malassezia spр. в патогенезе атопического дерматита (АД).
Антигенный состав Malassezia spp. Богатой антигенной структуре липофильных грибов приписывают свойство высокой иммуногенной активности, которая значительно превышает таковую у других представителей дрожжевой флоры, таких как, например, Candida albicans. Способность антигена вызывать индукцию антител в организме человека имеет чрезвычайно широкий полиморфизм. Она зависит как от состояния иммунной системы хозяина, от антигенного состава грибов, так и от особенностей окружающей человека среды (климата, состава воды, моющих средств, инсоляции, температуры, качественного состава сального секрета желез кожи). В настоящее время описано большинство известных антигенов основных видов рода Malassezia, исследована их биохимическая структура, способность к индукции IgE-антител в крови больных атопическим дерматитом, а также получено 13 основных рекомбинантных аллергенов [8, 9].
Особый тип иммунного ответа, отличный от такового у лиц без аллергии, на антигены Malassezia spp. формируется на протяжении жизни у больных АД. Один из наиболее значимых аллергенов для сенсибилизации организма больного АД — маннан липофильных грибов, вызывающий индукцию специфичных к нему IgE-антител и положительный прик-тест у половины пациентов, сенсибилизированных к Malassezia spp. Многочисленные исследования показали, что у пациентов, страдающих АД, но не ринитом и не астмой, индуцируются IgE-антитела к грибам рода Malassezia [10]. В нескольких фундаментальных биохимических исследованиях была выявлена высокая перекрестная реактивность между антигенами грибов Malassezia spp. и другими дрожжеподобными грибами, такими как Candida albicans, Rhodotorula rubra, Cryptococcus albidus и Saccharomyces spp. Она обусловлена гомологией антигенных детерминант высокомолекулярных маннопротеинов, выделенных из этих грибов. Считается, что первичную сенсибилизацию вызывают грибы Malassezia spp. [11].
На высвобождение аллергенов на коже влияет, прежде всего, рН на поверхности кожи, которая у пациентов с АД выше, чем у здоровых. Оказалось, клетки M. sympodialis продуцируют, экспрессируют и высвобождают в большом количестве аллергены при наиболее высоких значениях pH. Это особенно характерно для главного аллергена с весом 67-kDa, обозначаемым как Mala s 12 [12].
Иммунный ответ на Malassezia spp. Существует две противоречивых точки зрения на феномен индукции IgE-антител к антигенам дрожжей, в связи с доказанным фактом о том, что уровни специфических IgE к Malassezia коррелируют с уровнем общего иммуноглобулина Е, но не зависят от тяжести течения АД. Ряд авторов считает, что индукция антител к маннану липофилов — это лишь проявление атопического статуса, так как у 85% больных АД значительно повышен уровень общего IgE, и не является доказательством роли этих микроорганизмов в патогенезе АД. Другие, наоборот, считают, что это наиболее важный триггерный фактор АД.
Предполагается, что аутореактивность к собственным белкам человека у пациентов с АД играет роль одного из наиболее значимых патогенетических факторов при АД. Один из таких белков, фермент супероксид дисмутазы марганца (СДМ) — MnSOD, индуцируется при стрессовых ситуациях, как клетками организма человека, так и клетками грибов. Доказано, что фермент обладает свойством аллергенной активности (аутоаллерген при АД). Молекулярная мимикрия, приводящая к перекрестной реактивности, такой как сенсибилизация, к MnSOD, может быть первично обусловлена колонизацией кожи больных липофильными грибами [13].
Таким образом, липофильные дрожжи рода Malassezia, постоянно обитающие на коже человека, у больных АД начинают играть роль сильнейшего антигенного стимула. Если заселение поверхности кожи грибами происходит в первые годы жизни человека, то при наличии атопической предрасположенности оно является одним из первых аллергенов, вызывающих немедленный тип аллергической реакции. Учитывая перекрестную реактивность с другими дрожжеподобными грибами, которые постоянно присутствуют на слизистых оболочках, поступают каждый день с едой, с идентичными ферментами, вырабатываемыми кератиноцитами кожи, продуценты липофилов становятся главными триггерными и патогенетическими факторами АД на протяжении всей жизни.
Диагностика. Для диагностики АД, отягощенного колонизацией кожи Malassezia spp., используют микологические, иммунохимические, аллергологические методы.
Микологическое исследование с целью выделения и идентификации липофильных дрожжей рода Malassezia проводят методом соскоба и сбора с поверхности кожи на участке 1 см2 на ватный тампон. Далее производят пересев в трехкратной повторности на элективной среде Notman-агар (LNA): (10,0 г полипептона, 5,0 г глюкозы, 0,1 г дрожжевого экстракта, 8,0 г бычьей желчи, 1,0 мг глицерола, 0,5 г глицеролстеарата, 0,5 мг Tween 60, 10 мл молока и 12,0 г агара на литр). Чашки с посевом инкубируют в термостате при температуре 32 °C в течение двух недель. Видовую идентификацию представителей рода Malassezia проводят по морфологическим (морфология колоний, размер и форма клеток), физиологическим (рост при 37 °C, 40 °C) и хемотаксономическим (каталазная реакция, утилизация Tween 20, Tween 40, Tween 60, Tween 80) признакам. Подсчет средних значений КОЕ/см2 осуществляют в соответствии с количеством колоний, выросших на плашке с пробы, взятой с участка кожи в 1 см2.
По нашим данным у всех обследованных нами пациентов, страдающих АД, в том числе и детей, а также примерно у 70% здоровых пациентов без заболеваний кожи выделяют дрожжеподобные липофильные грибы рода Malassezia. Численность дрожжей рода Malassezia колеблется в пределах 10–106 КОЕ/см2. Численность дрожжей, выделенных с кожи верхней части тела, как правило, выше на один-три порядка по сравнению с таковой в пробах, полученных от здоровых пациентов. В среднем, численность Malassezia составляла 104–105 КОЕ/см2 у больных и 102 КОЕ/см2 у здоровых.
Нам удалось выделить четыре вида рода Malassezia: Malassezia sympodialis, Malassezia globosa, Malassezia furfur, Malassezia restricta. Доминирующим во всех исследованных образцах был вид Malassezia sympodialis. Его мы регулярно выделяли с кожи как больных, так и здоровых. Второе место по встречаемости занимают Malassezia globosa и Malassezia furfur.
Выявление IgE-антител к Malassezia spp. в сыворотке крови пациентов рекомендуется осуществлять иммунохемилюминесцентным методом на приборе UniCAP 100 (Phadia, Швеция) с применением соответствующих реагентов. Мы выявляли IgE-антитела к Malassezia spp. почти у 40% больных и ни у одного из здоровых пациентов (Рис.).
Средние значения концентрации IgE-АТ в сыворотке крови варьировали от 0,36 kU/l (1 класс) до 68,8 kU/l (5 класс). Наиболее часто их выявляли у больных старше 7 лет, у трех больных в возрасте 5 лет они уже присутствовали в значительной концентрации (более 0,36 kU/l ). Тем не менее, концентрация IgE-антител в группе детей была достоверно ниже (от 0,36 kU/l до 32,0 kU/l, среднее значение 8,06 ± 7,9 kU/l), чем в группе взрослых (от 0,39 kU/l до 68,8 kU/l, среднее значение 19,42 ± 16,7 kU/l) (р < 0,05).
Таким образом, несмотря на то, что в нашем исследовании IgE-антитела к Malassezia spp. выявляли только у 40% больных, клинические признаки сенсибилизации к дрожжеподобным грибам были отмечены у всех пациентов, включенных в испытание по соответствующим критериям. Присутствие и концентрация антител не зависели от тяжести проявления АД. Ранее выявлено, что у атопических пациентов, страдающих АД, но не ринитом и не астмой, индуцируются IgE-антитела к грибам рода Malassezia, поэтому большинство исследователей считают, что это наиболее важный триггерный фактор АД.
Таким образом, присутствие IgE-антител к грибам рода Malassezia в сыворотке крови больных АД не является признаком, определяющим тяжесть заболевания, но представляет собой маркер хронического течения АД. Весьма маловероятен факт, что в ходе «атопического марша» появление IgE-антител к грибам рода Malassezia в крови детей будет сопутствовать трансформации АД в ринит или астму с полной ремиссией дерматита. Вид и численность дрожжей рода Malassezia на коже не влияют на сенсибилизацию к этим грибам, то есть нет дозозависимого эффекта между уровнем антител и степенью колонизации грибов на коже. Полученные данные показывают, что видовой и количественный состав липофильных грибов, обитающих на коже, не влияет на патогенетический механизм АД.
Лечение АД с колонизацией кожи Malassezia spp.
Характерными чертами клинической картины АД у больных с поражением кожи верхней части тела являются связь обострений с респираторными инфекциями, с использованием в питании продуктов, содержащих дрожжеподобные грибы и легкоусвояемую углеводистую пищу, белый дермографизм кожи, низкий терапевтический эффект от антигистаминных препаратов и топических кортикостероидов, тяжелое течение заболевания. Большинство наших пациентов (63%) связывали обострение заболевания с употреблением в пищу продуктов, содержащих сахарозу, крахмал, муку спустя более 24 часов. Девять взрослых пациентов отмечали, что при приеме спиртных напитков, преимущественно вина и шампанского, в течение 2–5 часов у них появлялись яркая гиперемия и зуд кожи лица. У всех детей заболевание значительно обострялось после употребления пищи, содержащей дрожжи (хлеб, сдобные изделия) и сахар в течение суток. В этой связи наиболее значимыми в терапии больных, сенсибилизированных к дрожжам, является соблюдение диеты с пониженным содержанием легкоусвояемых углеводов, продуктов, способствующих брожению, и, самое главное, дрожжесодержащих ингредиентов. К таковым относятся, прежде всего, мучные изделия, содержащие пекарские дрожжи Saccharomyces spp., пиво, квас, шампанское, вино. Практически во всех консервированных соках, овощных консервах, морепродуктах находят дрожжеподобные грибы, такие как Rhodotorula spp. Повышенное содержание сахара в желудочно-кишечном тракте способствует брожению и размножению дрожжей рода Candida.
Удачные попытки проведенных контролируемых клинических испытаний системных антифунгальных препаратов в терапии больных АД не оставляют сомнений в том, что патология иммунного ответа атопических пациентов на грибы — комменсалы кожи человека, является одним из наиболее значимых факторов патогенеза АД. То есть снижение концентрации антигенных молекул дрожжей в организме, способных вызывать индукцию IgE-антител, приводит к весьма ощутимому терапевтическому эффекту. Но вопрос о тактике ведения больных с АД остается открытым. Элиминация дрожжей из организма не является окончательной целью лечения, так как в отсутствии резидентной флоры кожи значительно возрастает риск заражения патогенными микроорганизмами. Истинное решение проблемы состоит в том, чтобы найти то «золотое равновесие», при котором, даже учитывая индукцию IgE-антител к дрожжам, не наблюдают воспаления кожного покрова, то есть достигается симбиотический баланс. Назначение антимикотиков (Орунгал, Дифлюкан) целесообразно проводить только короткими курсами, в период обострений, с целью кратковременного снижения аллергенной экспозиции на атопический организм. Существует множество работ, в которых проводили подбор доз и продолжительности курсов лечения системными антимикотическими препаратами. Предлагают введение фунгицидных препаратов низкими дозами в течение длительного периода более 6 мес. Так, например Оргунгал назначают по 200 мг в сутки в 1–2 приема в течение 2 недель. При отсутствии положительного эффекта через 2 недели, лечение следует продолжать еще в течение 2 недель. Однако побочные эффекты от длительного приема системных антимикотиков представляют собой серьезную проблему, которую нельзя не учитывать при назначении столь пролонгированного курса. Именно поэтому, несмотря на удачные попытки лечения фунгицидами, в стандарт лечения атопического дерматита эти препараты пока не включены. И единого мнения по этому вопросу в литературе пока нет [14, 15].
Использование местных мазевых препаратов, обладающих антимикотическим эффектом, таких как тербинафин, клотримазол, пиритион цинка и другие, дает менее выраженный, но все же положительный терапевтический эффект. Включение их в терапию АД, несомненно, представляет собой важный компонент, так как эти препараты не обладают системным токсическим свойством и синдромом отмены, характерным для топических стероидов. Кроме того, не следует забывать, что в повседневный уход за телом должны быть включены косметические средства по уходу за кожей волосистой части головы и гели для душа, обладаюшие мягкой фунгицидной активностью (шампуни Низорал, Фридерм деготь, Скин-кап), которые пациенты должны использовать регулярно с целью снижения численности липофильных дрожжей на коже.
Заключение
В последнее время все чаще в периодической литературе обсуждаются вопросы о полиморфизме генетических и сенсибилизирующих факторов в иммунопатогенезе АД. Отсутствие IgE-опосредованной реактивности у 20% больных АД при совершенно аналогичной клинической симптоматике предполагает комбинацию сложных реакций, включающих неадекватный иммунный ответ на комменсалы кожи, такие как грибы Malassezia spp. и Staphylococcus aureus. Уникальные свойства липофильных грибов Malassezia позволяют им присутствовать на коже организма человека в течение всей жизни практически беспрепятственно. Их защитную роль как антибактериального и антифунгицидного агента, как ультрафиолетового фильтра и опухолевого депрессанта трудно переоценить. Яркое свойство супрессивного и стимулирующего эффекта на иммунную систему дает возможность переживать различные полиморфные неблагоприятные условия окружающей среды и состояния самого человека. Поражение кожного покрова лица, шеи и плеч — это характерный признак гиперчувствительности к Malassezia spp., который наблюдают примерно у 30–40% всех больных АД. Таким образом, сенсибилизация к грибам рода Malassezia является одним из наиболее значимых триггерных факторов в патогенезе АД.
Литература
- Eichstedt E. Pilzbildung in der Pityriasis versicolor. Frorip Neue Notizen aus dem Gebeite der Naturkunde Heilkinde. 1846, № 39, p. 270.
- Benham R. W. The cultural characteristics of Pityrosporum ovale–a lipophilic fungus // J. Investig. Dermatol. 1939, № 2, p. 187–203.
- Panja G. The Malassezia of the skin, their cultivation, morphology and species. Trans. 7th Congr. Far East. Assoc. Trop. Med. 1927, № 2, p. 442–456.
- Slooff W. C. Pityrosporum sabouraud. In J. Lodder (ed.): «The yeasts–a taxonomic study», 2nd ed. North Holland Publishing Co., Amsterdam, The Netherlands. 1970, p. 1167–1186.
- Guillot J., Gueho E. The diversity of Malassezia yeasts confirmed by rRNA sequence and nuclear DNA comparisons. Antonie Leeuwenhoek. 1995, № 67, p. 297–314.
- Ashbee H. R. Update on the genus Malassezia // Med Mycol. 2007. V. 45, № 4, p. 287–303.
- Wilde P. F., Stewart P. S. A study of the fatty acid metabolism of the yeast Pityrosporum ovale // Biochem. J. 1968, № 108, p. 225–231.
- Koyama T., Kanbe T., Ishiguro A. et al. Antigenic components of Malassezia species for immunoglobulin E antibodies in sera of patients with atopic dermatitis // J Dermatol Sci. 2001, v. 26, № 3, p. 201–208.
- Johansson S., Karlstrom K. IgE binding components in Pityrosporum orbiculare identified by an immunoblotting technique // Acta Dermato-Venereol. 1991, v. 71, p. 11–16.
- Zargari A., Midgley G., Back O. et al. IgE-reactivity to seven Malassezia species // Allergy. 2003, v. 58, № 4, p. 306–311.
- Huang X., Johansson S. G. O., Zargari A. et al. Allergen cross reactivity between Pityrosporum orbiculare and Candida albicans // Allergy, 1995, v. 50, p. 648–656.
- Selander C., Zargari A., Mollby R. et al. Higher pH level, corresponding to that on the skin of patients with atopic eczema, stimulates the release of Malassezia sympodialis allergens // Allergy. 2006, v. 61, № 8, p. 1002–1008.
- Schmid-Grendelmeier P., Flickiger S., Disch R. et al. IgE-mediated and T cell-mediated autoimmunity against manganese superoxide dismutase in atopic dermatitis // J. Allergy Clin Immunol. 2005, v. 115, 5, p. 1068–1075.
- Back O., Scheynius A., Johansson S. G. O. Ketoconazole in atopic dermatitis: therapeutic response is correlated with decrease in serum IgE. Arch. Dermatol. Res. 1995, v. 287, p. 448–451.
- Clemmensen O. J., Hjorth N. Treatment of dermatitis of the head and neck with ketoconazole in patients with type I sensitivity to Pityrosporum orbiculare. Semin. Dermatol. 1983, № 2, p. 26–29.
М. А. Мокроносова, доктор медицинских наук, профессор ГУ НИИВС им И. И. Мечникова, РАМН, Москва
Почему развивается заболевание
Малоссезия не вызывает кожных заболеваний, если не создаются определённые условия, которые способствуют её развитию. Условия, благоприятствующие переходу гриба из нормального микроорганизма к патогенному состоянию изучены учёными недостаточно.
Знаете ли вы? Собаки способны чувствовать сколько прошло времени. Они могут по-разному реагировать, когда их владельцев нет дома в разный промежуток времени.
Вероятнее всего, этому способствуют разного рода расстройства организма, которые в нормальном состоянии контролируют микробное заселение. Такие нарушения могут иметь физическую, химическую или иммунологическую природу. Чтобы возник малассезиозный дерматит необходимо наличие предрасполагающих факторов.
Снижение иммунитета
Иммунодефицит является возможной причиной развития заболевания. Иммунозащитные механизмы в нормальном состоянии ограничивают избыточное заселение кожи микробами. Но при их нарушении патогенное развитие гриба увеличивается.
Неправильный уход и условия содержания
Частые купания животного повышают влажность его кожи. Это способствует развитию грибка. Неправильный уход за животными со складками на коже или висящими ушами также может привести к его развитию. Малоссезия развивается на коже, рН которой находится в пределах 4–8.
Кожный покров собак среди млекопитающихся имеет самый высокий показатель рН. Этот показатель может разниться в зависимости от породы. Более щелочная кожа в большей степени подвержена инфекциям, чем кислотная. Высокий уровень рН в шампунях для собак способен вызвать раздражение если существуют проблемы с кожным покровом.
Хронические заболевания
К развитию грибка ведут ряд заболеваний: пищевая аллергия, эндокринные заболевания, дерматит, кератинизация, вирусный лейкоз. Связь между различными заболеваниями, инфекциями и размножением грибка недостаточно изучена. Но лечение заболевания иногда может предотвратить развитие или уменьшить его проявление.
Важно! Если на коже животного наблюдается повышенное размножения стафилококков, это провоцирует развитие и дрожжевых грибов, поскольку виды находятся в симбиотических отношениях.
Другие причины
На распространённость заболевания влияет климат территории. Высокая температура окружающей среды с повышенной влажностью благоприятно влияют на размножение грибка, а сухие погодные условия препятствуют этому процессу. Повышение температуры окружающей среды летом и весной ведёт к повышенному потоотделению, что может спровоцировать развитие болезни.
Какие породы собак предрасположены к малассезии
Предрасположенности животного к малоссезии в зависимости от возраста и пола нет. Но существуют породы, у которых заболевание появляется чаще. Среди них стоит выделить: бассет-хаунд, шотландский и австралийский терьер, кокер-спаниель, такса, миниатюрный пудель, ши-тцу.
Как проявляются симптомы
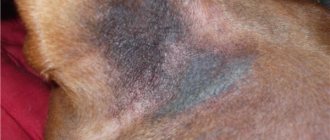
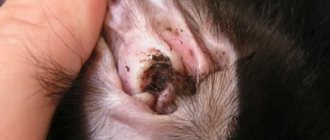
Поражения кожи могут наблюдаться в одном месте или разрозненно. В основном они встречаются на морде животного, передней части шеи, в наружном слуховом проходе, в подкрыльцовых ямках, паховой области, межпальцевых складках или в участках с опрелостями. Симптомы заболевания проявляются в покраснении кожи, частичном или полном облысении в поражённых местах, чешуйчатости или обильном жировом выделении.
Важно! Гриб Malassezia pachydermatis не передаётся человеку.
В хронических случаях наблюдается утолщение кожи как вторичный элемент сыпей, усиление кожного рисунка, нарушение пигментации поражённой зоны. Зуд кожного покрова может быть различной степени. Отличается заболевание специфическим запахом кожи и коричневыми выделениями из слухового прохода. Когти животного становятся также коричневого цвета.
Альтернативы стероидам при лечении атопии
Большинство хозяев, направляются к ветеринарному дерматологу, когда стероиды больше не эффективны или основное заболевание не позволяет их использовать (например, диабет, болезнь сердца). Поскольку аллергия на клещей домашней пыли, по-видимому, является распространенным аллергеном, который существует круглый год, стероиды не подходят.
В случае сезонно пораженных животных, бывают полезны случайные инъекции стероидов или пероральный преднизолон. Следует избегать длительного использования, ведь существуют другие варианты.
Хотя циклоспорин не предназначен для применения у кошек, он стал хорошей альтернативой стероидам при лечении атопических кошек. Препарат использовался с 1970-х годов для пересадки почек даже в более высоких дозах, чем у собак. (7,5-10 мг на кг в день).
Для кошек с атопическим дерматитом я рекомендую использовать 5 мг на кг или даже ниже для старта. Я начинаю с низкой дозы, чтобы избежать желудочно-кишечных побочных эффектов рвоты или диареи. Используются либо капсулы циклоспорина, либо пероральная жидкость, модифицированная циклоспорином, 100 мг / мл. И начинаем с 0,1 мл.
Недостаток пероральной жидкости заключается в том, что флакон на 50 мл необходимо использовать в течение 60 дней. Преимущество, на мой взгляд, меньше расстройств желудочно-кишечного тракта. Обязательно проверьте состояние токсоплазмоза перед применением. Использование циклоспорина может вызвать рецидив заболевания.
Возможно, было бы целесообразно избегать циклоспорина для уличных котов, учитывая возможность, что они едят сырое мясо. Было замечено, что у некоторых развивается легкая нейтропения. Поэтому важно проверять полный анализ крови и профиль сыворотки до и регулярно, во время использования.
После успехов в ежедневном приеме циклоспорина, переходите на прием через день и даже меньше. Его преимущество в том, что можно вводить перорально и для его эффективности не требуется несколько месяцев, в отличие от иммунотерапии.
Атопический дерматит у кошек — это реальность, и ее трудно лечить, не говоря уже о диагностике.
К счастью, есть больше вариантов, чем просто инъекции стероидов, которые раньше считались безопасными для кошачьих.
Теперь мы знаем, что диабет, демодекоз и болезни сердца иногда связаны с использованием гормонов. Поскольку атопия на всю жизнь, предпочтительнее использование доступных им альтернатив, которые намного безопаснее.
Чтобы получить подробную консультацию или квалифицированную помощь, обратитесь за помощью ко мне любым представленным на сайте способом. Более подробная информация на странице: лечение кожных заболеваний кошек
Терапия
Для лечения малассезии у кошек применяются наружные противогрибковые препараты, к которым относятся:
- шампуни;
- мази;
- растворы.
Чтобы терапия была более эффективной, перед нанесением данных средств лучше срезать длинную шерсть или побрить питомца.
Помимо такой обработки, следует внутрь давать таблетки, подавляющие развитие грибковой микрофлоры в организме. Целесообразность применения их котятам должен решать только врач, так как они оказывают пагубное воздействие на клетки печени.
Мыть кошку шампунем, содержащим фунгициды, следует 1 раз в 3 дня. Процедуру надо проводить на протяжении трех недель.
При малассезиозном отите необходимо:
- 2 раза в день очищать уши от скопившегося экссудата;
- обрабатывать слуховой проход антисептическим средством;
- закапывать противогрибковые капли;
- применять оральные фунгициды.
При наличии сопутствующих инфекций проводится лечение антибиотиками.
Пищевые аллергии устраняются путем изменения рациона питания питомца.
Следует понимать, что вовремя поставленный диагноз и правильно назначенная комплексная терапия могут дать быстрый положительный результат.
Гематома ушной раковины у кошек
При гематоме кровь изливается из кровеносных сосудов ушной раковины в ткани под значительном давлением, раздвигает эти ткани, и образует полость. Размеры гематомы зависят от силы кровяного давления в поврежденном сосуде, а также от степени податливости тканей, расположенных возле него.
Гематома возникает быстро, и ее объем увеличивается до тех пор, пока давление со стороны растянутых тканей не станет равным давлению в поврежденном кровеносном сосуде. После этого излившаяся кровь свертывается, а в кровеносном сосуде образуется тромб.
Чаще всего гематомы у кошек бывают на внутренней поверхности уха и гораздо реже снаружи. Поврежденное ухо увеличивается в размере, свисает вниз, на ощупь припухлость болезненная и горячая. Если гематому не лечить, то болезненность только нарастает, а сама гематома может инфицироваться вторичной микрофлорой, которая может привести в итоге к некрозу ушного хряща.
При клиническом осмотре такой кошки ветеринарный специалист отмечает следующие симптомы:
- У кошки наблюдаем беспокойство и нервозность.
- Кошка практически постоянно трясет головой из стороны в сторону.
- Своими лапами постоянно чешет поврежденное ухо.
- При попытке погладить кошку по голове становится агрессивной.
Лечение. Лечение гематомы ушной раковины не представляет больших трудностей. Если с момента образования ушной гематомы прошло не более 48часов, то владелец кошки фиксирует уши с помощью повязки на затылке и прикладывает холод. В дальнейшем с целью рассасывания гематомы необходимо использовать тепло и применять местно раздражающие мази.
В том случае если в домашних условиях вылечить гематому не удается, владельцу необходимо обратиться в ближайшую ветеринарную клинику. В ветеринарной клинике, ветврач вскрывает образовавшуюся гематому, удалит из нее сгустки крови, промоет образовавшуюся полость раствором новокаина с антибиотиками и даст рекомендации владельцу, чтобы гематома благополучно рассосалась.
Эффективна ли вакцинация кошек от лишая
Сегодня в ветеринарных аптеках представлены только российские вакцины для профилактики лишая у животных. За границей подобные средства исчезли и не применяются ввиду малой распространенности болезни.
Так как в России лишай очень часто регистрируют в сельском хозяйстве, пушном звероводстве и среди домашних питомцев, то есть востребованность в профилактических биопрепаратах. Однако до настоящего времени ни одна фармацевтическая компания не опубликовала достоверных данных или исследований, которые подтверждают эффективность вакцинации животных против лишая.
Наукой не доказано, что противогрибковые вакцины способны защитить от возможного заражения. Даже если многократно ставить прививку от лишая котятам или кроликам, при контакте с возбудителем животные все равно заболевают и проходят все стадии клинического развития наравне с теми, кого не вакцинировали.
Эффективность прививки изучали на небольшой группе подопытных животных, результат был положительным, поэтому вакцина от лишая существует.
На самом деле, для биопрепаратов (такие как вакцины) нужны более масштабные исследования и много животных с лишаем (причем подбирают питомцев по схожим физиологическим параметрам и одинаковой стадией развития болезни), что крайне затруднительно и финансово затратно. Поэтому многие опытные ветеринарные специалисты убеждены, что прививки от лишая не являются профилактической мерой. Однако у производителей вакцин на этот счет имеется своя точка зрения.
Как проходит диагностика
Чтобы определить грибок Malassezia pachydermatis используют различные методы диагностики. Среди них цитологические, патологические анализы и культивирование. Цитологическое исследование даёт возможность быстро установить наличие гриба. Для этого прозрачный скотч приклеивают к поражённой коже, а затем снимают. Взятый образец поддаётся специальной окраске и исследуется под микроскопом с увеличительной способностью в сто раз. В случае когда грибок легко устанавливается, то делают вывод о заражении кожи. В случае единичных обнаружений считают, что анализ дал негативный результат. Сухие соскобы и мазки являются альтернативными цитологическим методам.
Чтобы количественно оценить грибок используют для диагностики метод с использованием чашек Петри. Грибок культивируют в небольших чашках с специальной средой для размножения,прикладывая её к поражённому участку на 11 секунд. На протяжении 4–7 дней при температуре 32–37°С создают условия для выращивания гриба. Результат свидетельствует о плотности популяции грибка. Его интерпретируют, учитывая расположение заражённого участка на теле животного и породу собаки.
Важно! Используя биопсию можно увидеть грибок в сухом поражённом слое кожи. Гистологические срезы не всегда дают достоверный результат.
Возможна ли выработка иммунитета на грибок
У кошек не формируется резистентность к грибковым формам лишая после перенесенной болезни. Общий иммунитет вырабатывается исключительно клетками крови при проникновении чужеродного агента в кровеносное русло.
Грибки лишая не проникают в сосуды, живут на поверхности кожи и в шерсти животного. Соответственно, однажды переболевшая лишаем кошка, может заразиться вновь.
Существует теория о наличии местного (кожного) иммунитета в организме у живых существ. То есть лейкоциты кожи распознают антигены (в данном случае грибков) и вырабатывают к ним антитела. Тем более что грибки лишая контактируют с поверхностью кожи. Именно на этом факте основано предположение об эффективности прививок от лишая.
Насколько заразен грибок при малассезии
Употребляя термин «маллассезия», врачи подразумевают грибковый организм дрожжевого вида. Он по своей форме немного выпуклый и имеет цилиндрическое строение, гладкий, мягковатый, рыхлый, небольшой (если переводить на мкм, то он составляет два с половиной мкм). Посмотрев на него, вам может показаться, что видите обычный орешек. Культурам малассезии характерен необычный запах с «фруктовым» оттенком.
Увидев кого-то, больного малассезионным дерматитом, вы можете не шарахаться в сторону с испугом, не прятать подальше своего домашнего животного. Мнение, как будто малассезионный грибок заразен, совершенно ложное. Так как он является одной из составляющих микрофлоры, имеющей свойство в течение всей жизни присутствовать на эпителиальной ткани животного.
В обыденной жизни грибок не причиняет абсолютно никакого вреда. Чрезмерно быстрое и большое размножение берет начало после каких-либо происшествий, которые создают отличную среду для этого. Чаще всего это провоцируется при различных изменениях микроклимата кожного покрова (влажность, теплота, запущенная воспаленнность).